共焦拉曼显微镜凭借非侵入性与无标记检测特性,成为细胞生物学研究的核心工具。该技术通过激光激发结合分子非弹性散射效应,可精准获取细胞微环境的化学组成与结构信息,实现脂质、蛋白质、核酸等生物大分子的原位可视化表征及细胞内的分布解析。当前细胞生物学研究中,拉曼成像技术已广泛应用于脂质组织、代谢、感染及药物摄取等过程研究 [1-7]。 共焦拉曼成像的高空间分辨率和化学特异性使其成为理解各种生物过程中细胞复杂动态的宝贵工具。
WITec 系统卓越的拉曼技术可同时实现最高的分辨率、速度和灵敏度,从您的宝贵样本中获得最佳结果。WITec拉曼显微镜凭借其无与伦比的多功能性,成为适配当下及未来科研需求的理想平台。对于活样本的生物学应用,我们提供兼容环境和温度控制的配套设备。
共聚焦拉曼成像是一种非侵入性显微镜技术,非常适合在生理环境中研究活细胞而不造成损伤。在此案例中,使用 WITec alpha300 拉曼显微镜研究大鼠上皮细胞,获取了线粒体(蓝色)、内质网(绿色)和核仁(橙色)的特征拉曼光谱。彩色编码的拉曼图像直观地显示了这些细胞器在细胞内的空间分布。
点击应用查看更多
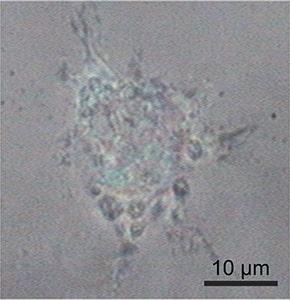
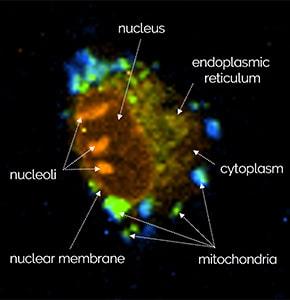
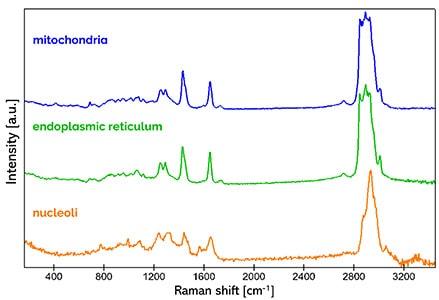
WITec 拉曼系统结合共聚焦技术和出色的纵向空间分辨率,可实现细胞三维结构的细节解析。此动画展示了水凝胶中间充质细胞的 3D 拉曼图像,直观呈现了所识别的不同细胞成分 1.
在细胞生物学研究中,荧光标记是可视化特定分子的常用方法。尽管拉曼成像提供了强有力的替代方案,WITec 显微镜仍可根据需求将两种技术连用,为需要额外荧光标记的应用场景提供支持。这些图片展示了 DAPI 染色真核细胞的拉曼-荧光关联成像。荧光图像显示标记的细胞核,而拉曼成像则识别出内质网(绿色)和核仁(橙色)。
点击应用查看更多
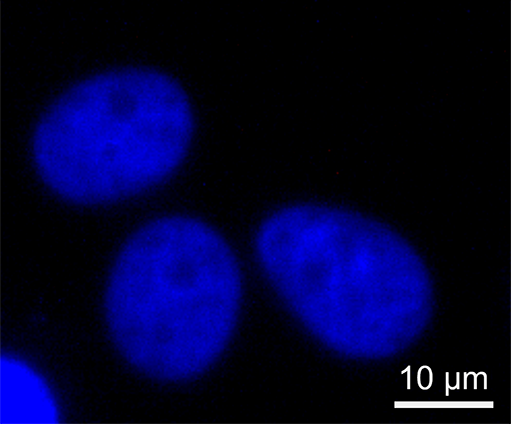
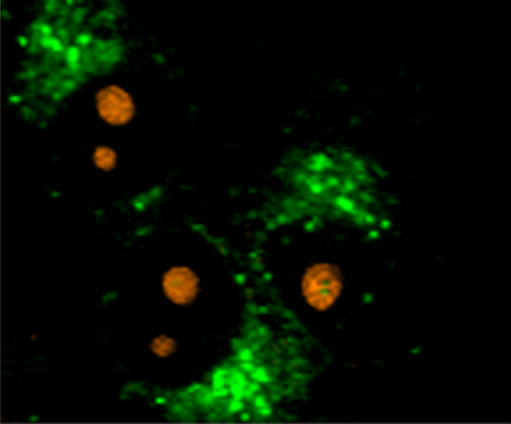
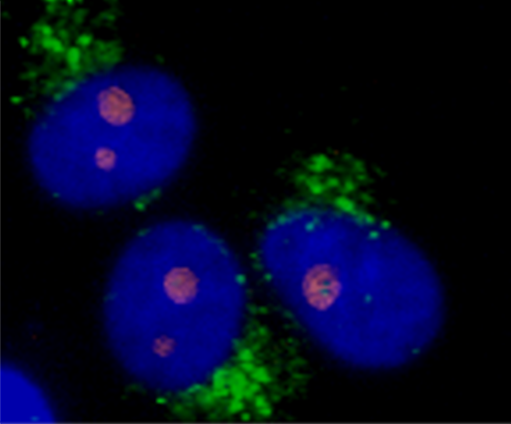
WITec 的多功能性可以将 拉曼显微镜与多种成像技术联用 ,在同一样品位置实现互补信息采集,包括:
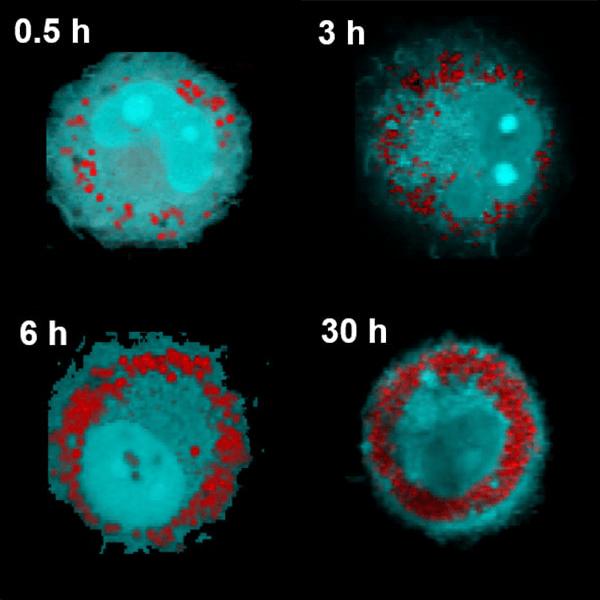
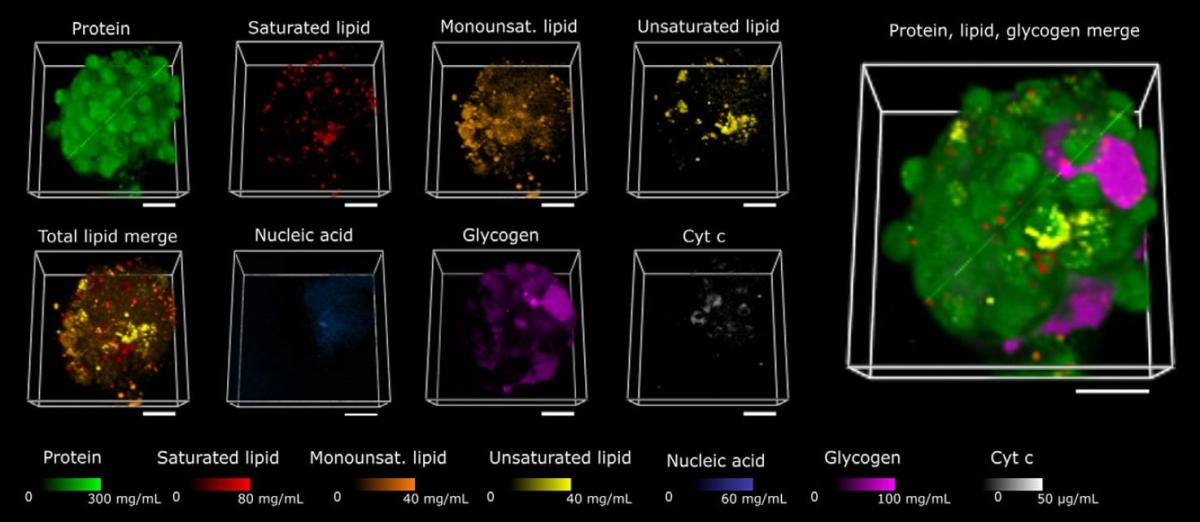
Application Note Confocal Raman Imaging and Correlative Techniques in Life Science
Customer publications:
 公安机关备案号31010402003473
公安机关备案号31010402003473